1 - Atome
Partie de matière extrêmement petite,
constituée d'un noyau autour duquel gravitent un ou plusieurs
électrons. Toute la masse d'un atome est concentrée dans son noyau.
Le noyau comprend des neutrons
électriquement neutres et des protons chargés d'électricité
positive.
Un atome est électriquement neutre car
les charges électriques positives contenues dans on noyau (protons)
sont équilibrées exactement par les charges électriques négatives
portées par les électrons circulant autour du noyau.
CARBONE (C) OXYGENE (O)
OXYGENE (O)




6 protons
8 protons
Noyau
C = 12
Noyau
O = 16
6
neutrons
8 neutrons
Représentation schématique des atomes de carbone et d'oxygène
Le symbole chimique C représente
l'atome-gramme de carbone, constitué par 6 x 1023 atomes
et pesant 12 grammes (masse atomique)
Le symbole chimique O représente
l'atome-gramme d'oxygène, constitué par 6 x 1023 atomes
et pesant 16 grammes
6 X 1023 = nombre d'Avogadro
2 - Molécule
Ensemble électriquement neutre
d'atomes, liés les uns aux autres dans des structures géométriques
bien définies formant le plus petit échantillon d'un corps pur
(simple ou composé)
* la molécule d'un corps simple est formée de plusieurs atomes d'un
même élément
exemple : H2, O2, N2 : molécules diatomiques
* la molécule d'un corps composé est formée d'atomes d'au moins 2
éléments différents
exemple : NH3 : molécule d'ammoniac, constituée d'un atome d'azote
et de 3 atomes d'hydrogène
H2O : molécule d'eau, constituée de 2 atomes d'hydrogène et d'un
atome d'oxygène

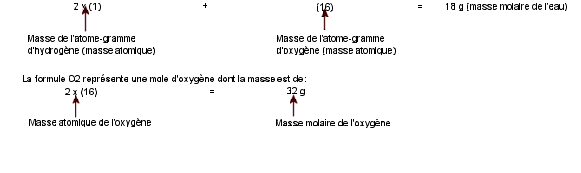
La formule chimique d'un corps pur
représente la mole (1) ou molécule-gramme, constituée par 6 X 1023
molécules, dont la masse est la masse molaire.
Ex : la formule H2O représente
une mole ou molécule-gramme d'eau, constituée par 6 X 1023
molécules d'eau, dont la masse est de
3 - Ion
Atome qui a perdu sa neutralité
électrique.
Dans certaines conditions, des atomes peuvent perdre un ou plusieurs
électrons, la charge positive du noyau l'emporte sur les charges
négatives des électrons restants, si bien que l'ensemble est chargé
d'électricité positive : on a un ion positif ou cation (2). Un atome
qui perd ainsi 1, 2 ou 3 électrons devient un ion porteur de 1, 2 ou
3 charges positives :
ex : l'anion chlorure Cl-, atome Cl plus 1 électron
l'anion sulfure S--, atome S plus 2
électrons
l'anion nitrate NO3- est constitué d'un
atome N, de 3 atomes O et d'un électron supplémentaire
l'anion sulfate SO4-- est constitué d'un
atome S, de 4 atomes O et de 2 électrons supplémentaires
La dissolution d'un produit dans l'eau
consiste à laisser des molécules de ce produit s'introduire au
milieu des molécules d'eau:
ex : dans l'eau les molécules de glucose C6H12O6 (glucide) se
dissolvent.
Dissociation dans l'eau : réaction
permettant la rupture des liaisons chimiques entre noyaux atomiques,
sous l'effet de la présence de l'eau, H+, H2O, Cl-
ex : dans l'eau, les molécules HCl se dissocient en ions H+ (cation
et Cl- (anion)
______________________________________________________________________________
(1) 1 millimole (mmole) = 10-3 mole = 0,001 mole
(2) les noms de cations et d'anions viennent de ce que, dans une
électrolyse (réactions chimiques provoquées par le passage du
courant électrique)les ions positifs se dirigent vers la cathode
négative et les ions négatifs vers l'anode positive.
4 - Acide
Corps qui, en solution dans l'eau,
libère des ions H+ (par simplification) :
ex : HCl dans l'eau se dissocie en ions H+ et Cl-
H2SO4 dans l'eau se dissocie en ions H+ et
SO4--
On dit que HCl et H2SO4 sont des acides ou qu'ils possèdent la
fonction acide.
Les acides en solution présentent un
certain nombre de caractères communs :
- action sur les indicateurs colorés : en présence
d'acide, l'hélianthine rougit;
- action sur certains métaux en donnant un dégagement
d'hydrogène;
- attaque du calcaire;
- saveur piquante;
- pH inférieur à 7.
5 - Base
Cors qui, en solution dans l'eau,
libère des ions OH- (ion hydroxyde) :
ex : NaOH dans l'eau se dissocie sous forme Na+ et OH-
Les bases en solution présentent un certains nombre de caractères
communs :
- action sur les indicateurs colorés : en présence de
base, la phénolphtaléine rougit;
- action sur les métaux (précipitation sous forme
d'hydroxydes métalliques)
- pH supérieur à 7
6 - Sel
a) un sel est le résultat de l'action
d'un acide sur une base.
exemple :
H+ + Cl-
+
Na+ + OH-
==> Na+Cl-
+
H2O +
chaleur
acide
+
base
==> sel
(acide chlorhydrique)
(soude)
(chlorure de sodium)
b) un sel peut être obtenu par action
d'un acide sur certains métaux :
exemple :
2 (H+ +
Cl-) +
Zn
==> Zn++
+ 2Cl-
+ H2
acide
+ métal
==> sel
+
hydrogène
(acide chlorhydrique) (zinc)
(chlorure de zinc)
(hydrogène)
Un sel est un composé ionique. par
exemple, le chlorure de sodium est constitué du cation Na+ et de
l'anion Cl-.
Un sel en solution se dissocie.
Les noms des sels dérivent de ceux de leurs ions. Ainsi :
- les sels donnés par l'acide chlorhydrique sont des chlorures :
leur anion est l'ion chlorure Cl-
- les sels donnés par l'acide nitrique sont des nitrates : leur
anion est l'ion nitrate NO3-
- les sels obtenus avec la soude ont tous comme cation, l'ion Na+ :
se sont des sels de sodium
- les sels obtenus avec la potasse ont tous comme cation, l'ion K+ :
se sont des sels de potassium.







7 -
Oxydoréduction (au sens strict)
a) réducteur (au
sens strict) - corps , qui dans certaines conditions, peut prendre
de l'oxygène à un composé oxygéné : ex : les matières organiques;
b) oxydant (au sens strict) - corps, qui dans certaines
conditions, peut céder de l'oxygène;
ex : certains composés oxygénés (ozone, eau oxygénée,...)
c) réduction (au sens strict) : réaction dans laquelle un composé
perd de l'oxygène;
d) oxydation (au sens strict) : réaction dans laquelle un élément
se combine à l'oxygène;
L'oxydation d'un
composé s'accompagne toujours de la réduction d'un autre et la
réaction est appelée une oxydoréduction.
exemple :
l'Hydrogène enlève de l'oxygène à l'oxyde cuivrique et fixe cet
oxygène pour former l'eau; on dit qu'il joue le rôle de réducteur.
L'oxyde cuivrique qui cède son oxygène à l'hydrogène joue le rôle
d'oxydant.
H2
+
CuO
--------------------------->
H2O
+ Cu
réducteur
oxydant
oxydoréduction
eau
cuivre
Comme l'oxydation
de l'hydrogène et la réduction de l'oxyde cuivrique se produisent
simultanément, la réaction est appelée une oxydoréduction
Une oxydation ou
une réduction au sens strict peut donc se définir comme un
transfert d'oxygène.
Exemple :
réducteur
oxydant
Matières organiques
bichromate de
ou
potassium (K2Cr2O7)
oxydation
matières réductrices
+ ou
----------------------------> CO2+H2O+...
(C, H, O, N, P, S,...)
permanganate de
potassium (KMnO4)
(composés oxygénés)
8 -
Oxydoréduction (au sens large)
a) réducteur (au
sens large) : corps dont les molécules ou les ions peuvent, dans
certaines conditions, céder un ou plusieurs électrons.
exemple :
Fe++
oxydation
Fe+++
+
e-
ion ferreux ------------------------>
ion ferrique
électron
(cation)
(cation)
L'oxydation se
traduit par une perte d'électrons.
b) oxydant (au
sens large) : corps dont les molécules ou les ions peuvent, dans
certaines conditions, capter un ou plusieurs électrons.
exemple
oxydant
Cl2
+
2e-
réduction
2Cl-
--------------->
du chlore
molécule
ion chlorure
de chlore (oxydant)
(anion)
La réaction se
traduit par un gain d'électrons.
Une oxydation ou
une réduction au sens large peut donc se définir comme un
transfert d'électrons.
La première
réaction chimique peut également s'écrire :
oxydation
2 Fe ++ ------------------>
2 Fe +++
+
2e-
L'équation
chimique d'oxydoréduction sera donc :
2Fe++
+
Cl2 + 2e-
--------------------> 2Fe+++
+ 2Cl-
+ 2e-
ou, plus
simplement
2Fe ++
+
Cl2 ------------------------>
2Fe +++ +
2Cl-
Dans cette
équation chimique, l'oxygène n'apparaît pas mais il y a
modification des charges électriques portées par le atomes de
chlore et de fer. Il y a transfert d'électrons du fer au chlore :
chaque ion ferreux Fe++, en devenant ferrique Fe+++, perd un
électron qui se fixe sur un atome de chlore pour donner un ion
chlorure Cl-.
9 - degré
d'oxydation
Le degré
d'oxydation est le nombre d'oxydation. Quand un élément est oxydé
son nombre d'oxydation croit en valeur algébrique. Quand il est
réduit, ce nombre diminue,
ex :
NH4+
--->
NO2-
--->
NO3-
(degré d'oxydation
(degré d'oxydation
(degré d'oxydation
de N
= 3)
de N = +3)
de N = +5)
Il s'agit de la
nitrification. La nitrification est un processus d'oxydation.
ex :
NO3-
--->
NO2-
-->
N2O -->
N2
(degré d'oxyd
(degré d'oxyd
(degré d'oxyd
(degré d'oxyd
de N = +5)
de N = +3)
de N = +1)
de N = 0)
La dénitrification
est un processus de réduction.
10 -
Electronégativité
L'électronégativité
se définit comme l'aptitude d'un atome dans une molécule à attirer
à lui les électrons de liaison. Les éléments qui perdent aisément
des électrons sont situés en bas et à gauche de la classification
périodique. (Plus l'électron est loin du noyau plus il est facile
de l'arracher). Ils sont appelés éléments électropositifs. Les
éléments qui captent facilement des électrons se trouvent dans la
partie supérieure droite de la classification périodique. Il sont
appelés éléments électronégatifs.
Ex : le césium est
très électropositif, le fluor très électronégatif. Plus la
différence d'électronagativité entre 2 éléments est grande, plus
la réactivité entre ces éléments est forte.
11 - Réaction chimique
Une réaction
chimique est une transformation au cours de laquelle des corps
purs (simples ou composés) mis en présence disparaissent en
donnant naissance à d'autre corps purs. Dans une réaction chimique
la masse et la nature des éléments se conservent. Le noyau ne
subit pas de transformation.
12 - Catalyseur
Substance présente
lors d'une réaction mais qui n'y participe pas; son rôle est
d'optimiser la réaction.
ex. de catalyseur
: chaleur
enzyme dans une réaction de type organique
13 - Saturation
(ou solubilité maximale)
C'est la quantité
maximale d'une substance qu'un solvant peut dissoudre par unité de
volume.
ex : pour
l'oxygène dissous : 11,26 mg/l à10° C (dans l'eau)
pour le chlorure de sodium (NaCl) : 263,2
g/l à 10° C (dans l'eau)
La solubilité
dépend du solvant, de la nature du produit à dissoudre, de la
température. Elle croît, à l'exception des gaz, avec la
température.
14 - Pouvoir
tampon
Il est la
propriété d'une solution caractérisée par un pH qui varie peu, par
addition d'un acide ou d'une base ou par dilution.
Exemple : le
pouvoir tampon de l'eau est lié notamment à sa teneur en
hydrogénocarbonate. Plus une eau est riche en HCO3-, plus sont
pouvoir tampon est élevé.
15 - Indicateur
coloré
Substance ayant la
propriété de changer de couleur sous l'influence d'un acide ou
d'une base (ex.: BDH, phénolphtaléine) ou sous l'influence d'un
oxydant ou d'un réducteur (ex.: bleu de méthylène, ferroïne)
Ex. : - les
bandelettes plastifiées de pH contiennent des indicateurs colorés
de base et d'acide,
- le bleu de méthylène est bleu en
milieu oxygéné et incolore en milieu réduit.
16 -
Concentration
Quantité de
substance dans un volume ou masse donnée. La concentration peut
être exprimée en mg/l, µg/l, % ...
17 - Flux
Quantité de
substance par unité de temps
Flux = concentration x
débit
Le flux peut être exprimé
en mg substance/s, kg substance/j,...





HAUT DE
PAGE
RETOUR