Les tests de terrain retenus (en plus
de la température) sont au nombre de 9 :
|
- pH |
- Recherche de sels ammoniacaux |
- Recherche des cyanures |
|
- conductivité |
- nitrites |
- recherche des sulfates |
|
- oxygène dissous |
- recherche du chlore |
- recherche des chlorures |
Ces tests ont été choisis pour :
- tenir compte de la nécessité de
contrôler et de stabiliser certains toxiques susceptibles de
disparaître au cours du transport;
- aider à l'identification des pollutions
- aider à la localisation du flot polluant
- obtenir des indications rapides et précieuses sur l'état du milieu
récepteur (teneur en oxygène dissous, altération physico-chimique)
Ils sont d'une grande facilité de mise
en oeuvre.
Les croix sur le tableau ci-dessous
indiquent les tests à effectuer sur le terrain :
| |
Pollution
mécanique
(extraction
vidange) |
Pollution
organique
(collectivité
élevage
IAA)(1) |
Pollution
par
substance
toxique* |
Pollutions spécifiques
|
Pollution
incon-
nue |
Lessivage
de
terrils |
Traitement
de substances
carbonées
à haute
températ. |
Application
de
béton |
Traitement
d'eau
potable
d'eau de
piscine |
Détartrage
et
désinfection |
Fabrication
de circuits
imprimés |
pH
|
|
(X) |
X |
X |
|
X |
|
X |
X |
X |
|
conduc-tivité
|
|
X |
X |
X |
|
X |
|
X |
X |
X |
Oxygène
dissous |
X |
X |
X |
X |
X |
|
X |
X |
X |
X |
Sels
ammo-
niacaux |
(X) |
X |
X |
|
|
|
|
|
X |
X |
Chlore
|
|
|
X |
|
X |
|
X |
X |
|
X |
Cyanure
|
|
|
X |
X |
X |
|
|
|
|
X |
Nitrites
|
(X) |
X |
X |
|
|
|
|
|
|
X |
Sulfates
|
|
|
X |
X |
|
|
|
X |
|
X |
Chlorure
|
|
(X) |
X |
X |
|
|
|
X |
X |
X |
(X) : souhaitable
(1) : Industries agro-alimentaires
* : chimie, traitement de surface, industrie mécanique
Remarques :
- Une pollution pouvant être mixte, il serait souhaitable de
procéder dans tous les cas au test du pH et de la conductivité
- Il est inutile de procéder à la mesure de l'oxygène dissous dans
les effluents sans mélange avec le milieu récepteur.
pH
Définition et signification
Définition
Le pH est la grandeur utilisée pour caractériser le degré d'acidité
ou de basicité d'un milieu
Signification
Apport
d'un acide ---------------------------------->
Le pH descend
(acide chlorhydrique, sulfurique, nitrique,...
acides organiques liés à la dégradation de
la matière organique)
Apport d'une base
--------------------------------->
Le pH monte
(carbonates, ammoniaque, soude, potasse,...)
- La mesure du pH renseigne sur la
qualité de l'eau : dans les eaux naturelles non soumises aux rejets,
le pH dépend de l'origine de ces eaux et de la nature géologique du
terrain.
On rencontre des pH faibles (6,5 et
même 5,5) dans les régions granitiques, des pH supérieurs à 8,5 dans
les eaux closes, les retenues ou dans les bras morts, consécutifs à
la formation temporaire des carbonates alcalins sous l'action d'une
photosynthèse très active.
- La mesure du pH peut permettre de
localiser une source de pollution.
Echelle de pH
|
14 |
|
 milieu
basique milieu
basique
|
Hydroxydes (soude,…) |
|
|
|
|
|
10,0 |
|
|
|
|
|
|
|
|
|
Carbonates |
|
8,5 |
|
|
Eaux minéralisées de
régions calcaires
Majorité des eaux
piscicoles |
|
|
|
6,5 |
|
|
  Eaux peu minéralisées ex : régions granitiques d'origine
volcanique
Eaux peu minéralisées ex : régions granitiques d'origine
volcanique
|
|
|
|
5,5 |
|
|
|
|
Acidité faible
(acidité
organique ou minérale) |
|
|
|
3,0 |
|
|
|
Milieu acide |
Acidité forte
(acide sulfurique,
nitrique, chlorhydrique) |
|
|
|
1 |
|
|
|
|
|
|
|
Milieu pollué |
|
|
pH
Mode opératoire
Matériel
- Bandelettes plastiques. Conviennent
en particulier :
- bandelettes MERCK, pH de 0 à 14
- bandelettes CARLO ERBA, pH de 1 à 11
- Comparateur de pH avec des tubes ou
disques. Convient en particulier :
- coffret AQUAMERCK n° 1.08038, pH de 4,5 à 9,0
- pHmètre avec solutions de référence
pH = 4,0-7,0-9,0 ou 10,0 (longue conservation en flacon brun)
Mode opératoire
*Estimation directe du pH par comparaison avec une échelle colorée

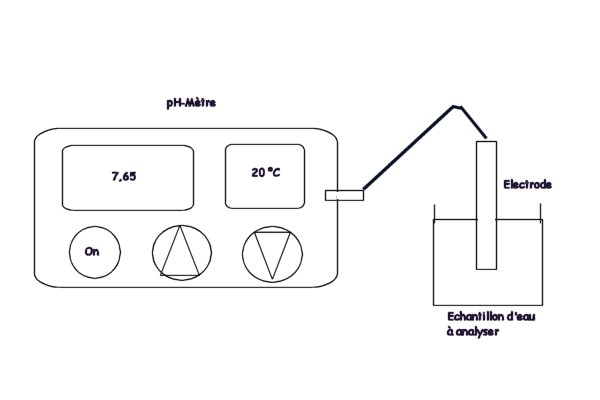
* Méthode électrométrique au moyen d'un
pH mètre (1)
Le mode opératoire est précisé dans la notice du
fabricant.
Cette méthode utilisée pour les mesures
précises nécessite avant l'utilisation :
- l'étalonnage de l'appareil avec des solutions du
commerce à pH 4,0, 7,0, 9,0 ou 10,0
- le pré rinçage des électrodes et du bécher à l'eau
déminéralisée, puis avec la solution à analyser
après utilisation :
- le rinçage à l'eau déminéralisée
- la conservation de l'électrode dans l'eau
déminéralisée
Les mesures sont exprimées en utilisant
le dixième d'unité pH pour dernier chiffre significatif . Exemple :
8,3 et non 8,32.
________________________________________________________________________________
(1) Le principe de la mesure pH repose sur l'existence entre 2
électrodes (conducteur de constitution complexe) d'une tension
électrique convertie en unité de pH. Le pH mètre est en réalité un
millivoltmètre.
HAUT DE
PAGE
RETOUR